Industry dynamic
行業(yè)動(dòng)態(tài)
您當前所在位置:

行業(yè)動(dòng)態(tài) / Industry dynamic
行業(yè)動(dòng)態(tài)詳情 / Industry news details
行業(yè)資訊
Industry news
全部行業(yè)動(dòng)態(tài)
All industry dynamic
政策法規
Policies regulations
研發(fā)動(dòng)態(tài)
Research news
2018 醫藥研發(fā)競賽新格局:哪些產(chǎn)品搶進(jìn)度?
來(lái)源:醫藥經(jīng)濟報
|
作者:pmob10514
|
發(fā)布時(shí)間: 2018-01-04
|
1715 次瀏覽
|
分享到:
截至2018年1月3日,2017年CDE藥物臨床試驗登記與信息公示平臺的數據重新回歸到四位數,如圖1所示,回升到1250個(gè)登記號,是近四年的新高。從適應癥來(lái)看,腫瘤和心腦血管相關(guān)的藥品依然是熱點(diǎn),預防血栓的藥品也在逐步增多。
2018 醫藥研發(fā)競賽新格局:哪些產(chǎn)品搶進(jìn)度?
截至2018年1月3日,2017年CDE藥物臨床試驗登記與信息公示平臺的數據重新回歸到四位數,如圖1所示,回升到1250個(gè)登記號,是近四年的新高。從適應癥來(lái)看,腫瘤和心腦血管相關(guān)的藥品依然是熱點(diǎn),預防血栓的藥品也在逐步增多。
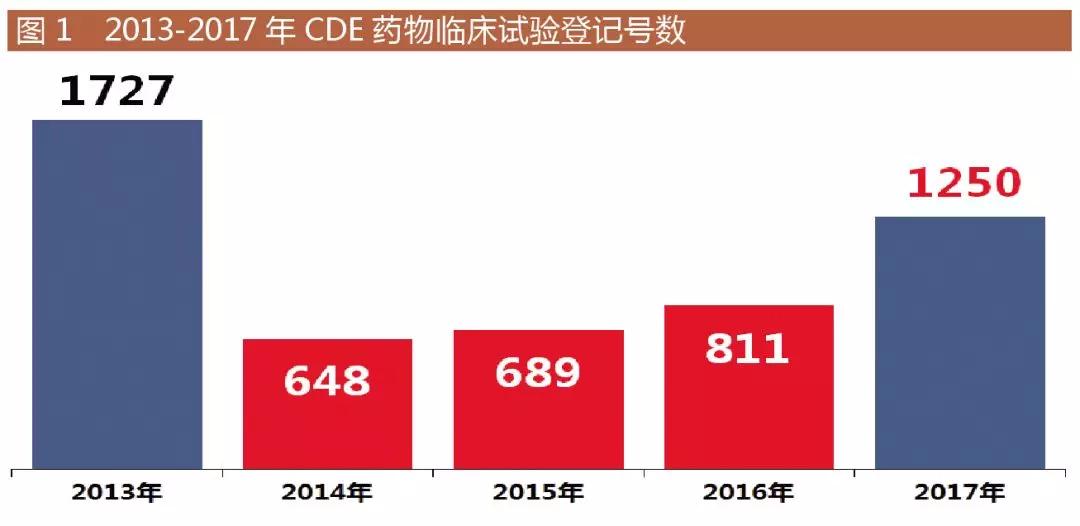
2017年一致性評價(jià)相關(guān)政策發(fā)布完畢,仿制藥回熱;2017年底發(fā)布的鼓勵藥品創(chuàng )新實(shí)行優(yōu)先審評審批的意見(jiàn)明確,專(zhuān)利到期的仿制藥可獲得優(yōu)先審評。那么,哪些是企業(yè)既要爭取排名又要爭取質(zhì)量順利過(guò)關(guān)的項目?
筆者進(jìn)一步分析2017年啟動(dòng)臨床的項目情況,并整理出專(zhuān)利到期的仿制藥擬納入優(yōu)先審評的產(chǎn)品清單,探索2018年國內的研發(fā)競賽新格局。
臨床登記號TOP 10:
仿制藥熱度歸來(lái)
如表1所示,登記號排名前十的的產(chǎn)品中有9個(gè)是仿制藥,前五的全是仿制藥。由此可見(jiàn),2017年啟動(dòng)臨床的項目主要是仿制藥。

咸達數據V3.5對比2017年藥物臨床試驗登記號數前十的口服仿制藥對應的2016年與2017年的國內仿制廠(chǎng)家發(fā)現,除了富馬酸替諾福韋二吡呋酯片和吉非替尼片在2016年首家仿制藥廠(chǎng)家獲批之后所帶來(lái)的仿制潮外,其余藥品2017年登記臨床的仿制藥廠(chǎng)家數遠遠高于2016年。
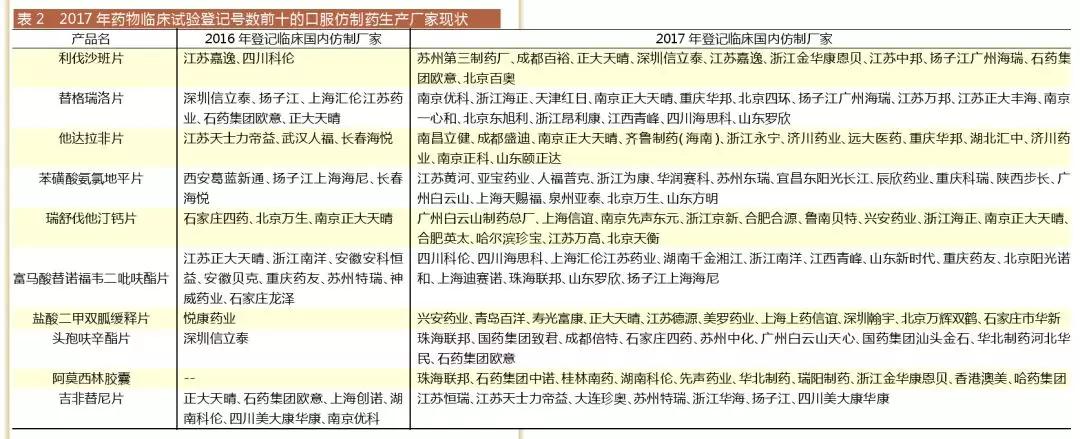
申報熱點(diǎn):
心血管藥、抗凝藥、289大品種
2017年仿制藥的臨床登記數創(chuàng )新高,讓人不禁回顧起2015年臨床自查核查啟動(dòng)前,各大研發(fā)生產(chǎn)企業(yè)都在緊盯首家仿制藥的臨床批件的審批順序,當時(shí)排名越前列的受理號市場(chǎng)價(jià)值越高。
2015年臨床自查核查啟動(dòng)以后,一致性評價(jià)相關(guān)政策文件發(fā)布前,臨床批件批量發(fā)布,排名前列不再是市場(chǎng)價(jià)值的唯一衡量標準,項目質(zhì)量的重要性提高。這段時(shí)期,各大仿制藥研發(fā)生產(chǎn)企業(yè)進(jìn)入沉默期,創(chuàng )新藥申報熱度不減,“雙報”產(chǎn)品可能在國內上市免臨床并且獲得一致性評價(jià)稱(chēng)號的政策利好推動(dòng)企業(yè)“走出去”。
2017年一致性評價(jià)相關(guān)政策發(fā)布完畢,仿制藥回熱,企業(yè)既要爭取排名,又要爭取項目質(zhì)量能夠順利過(guò)關(guān)。
從適應癥來(lái)看,心腦血管相關(guān)、預防血栓抗凝血的仿制藥是申報熱點(diǎn)。此外,289目錄中銷(xiāo)售額較大的產(chǎn)品的競爭態(tài)勢也較為激烈。
專(zhuān)利到期藥納入優(yōu)先審評:
產(chǎn)品清單
2017年12月28日,國家食藥監總局關(guān)于鼓勵藥品創(chuàng )新實(shí)行優(yōu)先審評審批的意見(jiàn)發(fā)布。據此,兩類(lèi)仿制藥獲得優(yōu)先審評——專(zhuān)利到期前3年的藥品臨床試驗申請和專(zhuān)利到期前1年的藥品生產(chǎn)申請;以及在中國境內用同一生產(chǎn)線(xiàn)生產(chǎn)并在美國、歐盟藥品審批機構同步申請上市且通過(guò)其現場(chǎng)檢查的藥品注冊申請。
截至2018年1月3日,共41個(gè)受理號因專(zhuān)利到期而進(jìn)入CDE擬納入優(yōu)先審評程序藥品注冊申請的產(chǎn)品清單,“首批優(yōu)先審評專(zhuān)利到期品種和申請人名單”對應14個(gè)受理號,其中只有1個(gè)是臨床申請,專(zhuān)利到期前3年的臨床申請只有1個(gè)受理號,專(zhuān)利到期前1年的藥品生產(chǎn)申請的受理號有26個(gè)。
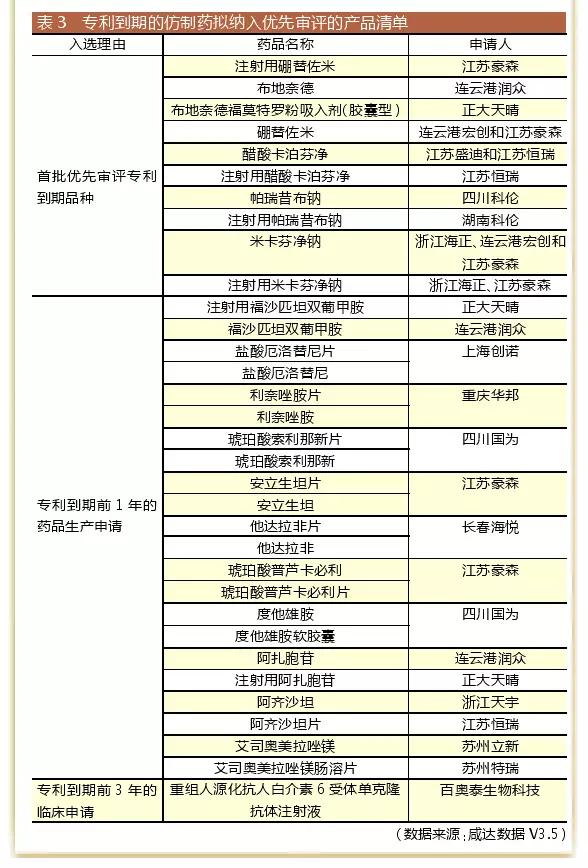
從生產(chǎn)廠(chǎng)家來(lái)看,浙江海正、正大天晴、江蘇恒瑞和江蘇豪森的產(chǎn)品進(jìn)入擬納入優(yōu)先審評程序藥品注冊申請的受理號數較多。
展望<<<
首批通過(guò)一致性評價(jià)品種已公布,這將會(huì )更加刺激研發(fā)機構和生產(chǎn)企業(yè)在2018年登記臨床搶進(jìn)度。仿制藥由于市場(chǎng)培育較為成熟,在一致性評價(jià)和MAH制度的推動(dòng)下,研發(fā)機構和生產(chǎn)企業(yè)會(huì )搶奪仿制藥一致性評價(jià)的稱(chēng)號,并有望在批文洗牌中打破現有競爭格局。預計2018年的新格局將是——市場(chǎng)較大的產(chǎn)品和專(zhuān)利到期的仿制藥一致性評價(jià)稱(chēng)號的搶奪大戰。



